Дестабилизирующие белки функции. Роль белков MAP в стабилизации микротрубочек
Американские биологи расшифровали эволюционный механизм, позволяющий бактериофагу лямбда в лабораторных экспериментах вырабатывать новый способ заражения бактериальных клеток. Эволюционное новшество возникает в ответ на приобретение бактериями устойчивости к старому способу вирусной атаки, основанному на прикреплении вирусного белка J к бактериальному поверхностному белку LamB. В этой ситуации отбор сначала закрепляет мутации гена J , усиливающие старую функцию. «Платой» за лучшее связывание с LamB становится дестабилизация белка J. В итоге получаются вирусы, у которых при одном и том же геноме белок J может иметь две разные пространственные конфигурации. При этом вирусные частицы с «правильно» свернутым J заражают жертв старым способом, а другие (с таким же геномом, но с «неправильно» свернутым J) делают это по-новому, прикрепляясь к другому поверхностному белку бактерии (OmpF). В дальнейшем оба варианта могут стабилизироваться путем закрепления дополнительных мутаций, что фактически приводит к разделению исходного вируса на два вида. Работа подтверждает старую, но имеющую мало экспериментальных подтверждений идею о том, что новые функции могут развиваться через промежуточный этап дестабилизации фенотипа с последующей стабилизацией («генетической ассимиляцией») удачных ненаследственных отклонений.
Теоретики давно обсуждают возможную роль дестабилизации фенотипа в появлении эволюционных новшеств. Предполагается, что новшества могут возникать по следующей схеме: «исходный стабильный фенотип → дестабилизирующее воздействие (например, резкое изменение среды) → рост негенетической изменчивости → генетическая ассимиляция удачного фенотипа, то есть закрепление мутаций, стабилизирующих тот вариант фенотипа, который оказался адаптивным в новых условиях ». Об этой модели подробно рассказано в новости Дестабилизация развития - путь к эволюционным новшествам («Элементы», 13.07.2009). Идея выглядит логичной, однако прямых экспериментальных подтверждений у нее пока немного (см. ссылки в конце новости).
Американские биологи, работающие с бактериофагом лямбда (см. Lambda phage), пополнили коллекцию подтвержденных примеров действенности данного механизма еще одним экспонатом.
Изучалось эволюционное новшество, систематически возникающее у фага λ в определенных условиях. В норме этот фаг заражает своих жертв, кишечных палочек Escherichia coli , прикрепляясь к поверхностному белку (рецептору) LamB. Однако жертвы могут выработать устойчивость к вирусу путем накопления мутаций, снижающих уровень экспрессии этого рецептора. Количество молекул LamB на поверхности бактериальных клеток уменьшается, и вирусу становится не за что ухватиться.
В присутствии устойчивых бактерий вирусы подвергаются интенсивному отбору на способность как можно эффективнее цепляться за те немногие молекулы LamB, которые еще остались. Отбор последовательно закрепляет 4–7 мутаций в вирусном гене, кодирующем белок J. Этот белок располагается на конце ножки вируса и отвечает за прикрепление к LamB (рис. 1).
Неожиданным образом эти мутации не только повышают прочность связи с LamB, но и придают белку J новую способность - прикрепляться к другому поверхностному белку бактерии, OmpF. Фактически вирус вырабатывает новый способ заражения бактериальных клеток. Такие вирусы успешно заражают бактерий, даже вовсе лишенных LamB (J. R. Meyer et al., 2012. Repeatability and Contingency in the Evolution of a Key Innovation in Phage Lambda).
Недавно было показано, что получившиеся вирусы-генералисты (способные заражать своих жертв двумя способами) могут затем снова специализироваться, то есть утратить один из двух способов заражения, оптимизировав другой. Это может привести к видообразованию (разделению на два вида). Хотя у фагов λ нет полового размножения, у них есть рекомбинация - обмен участками генома между вирусами, заразившими одну и ту же клетку. С точки зрения эволюционных последствий это почти то же самое, что и половое размножение. Оказалось, что адаптация к хозяевам, у которых есть только один из двух рецепторов (LamB или OmpF), ведет к разделению вирусов-генералистов на две специализированные группы, каждая из которых способна заражать только один тип жертв. Такие вирусы уже не могут меняться друг с другом генами, потому что в их геномах закрепляются несовместимые мутации (J. R. Meyer et al., 2016. Ecological speciation of bacteriophage lambda in allopatry and sympatry). Поэтому их вполне можно считать разными видами.
В ходе нового исследования, результаты которого опубликованы в журнале Science , американские вирусологи разобрались в том, каким образом белку J вирусов-генералистов удается совмещать две функции. У клеточных организмов такие эволюционные изменения обычно происходят за счет дупликации гена с последующим разделением функций между копиями. Но у фагов-генералистов ген J не дуплицирован.
Альтернативный механизм связан с дестабилизацией белка. Авторы предположили, что мутации, закрепившиеся в гене J у фагов-генералистов, внесли элемент хаоса в процесс сворачивания кодируемого белка (см. Фолдинг белка). Возможно, белок J у фагов-генералистов может принимать две разные конформации, одна из которых связывается с LamB, а другая - с OmpF.
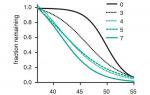
Дестабилизация пространственной структуры белка часто сопровождается снижением его устойчивости к повышению температуры. Поэтому проверку своей гипотезы ученые начали с оценки выносливости вирусов к перегреву. Для этого они в течение часа выдерживали вирусные частицы с разными генотипами при разных температурах (от 37°С - оптимальной температуры для фага λ до смертельных 55°С) и смотрели, какой процент вирусов сохранит жизнеспособность. В эксперименте использовались генотипы, соответствующие разным этапам изученного ранее эволюционного пути от исходного вируса (связывающегося только с LamB) к вирусу-генералисту. Изучаемые вирусы различались только мутациями в гене J , а весь остальной геном у них был одинаковый.
Результаты подтвердили ожидания исследователей (рис. 2). Выяснилось, что мутации в гене J , которые в ходе адаптации вирусов к жертвам с пониженной экспрессией LamB повышали сродство J к LamB, а затем дали возможность связываться также и с OmpF, попутно снижали термостабильность белка J.

Впрочем, это само по себе еще ни о чем говорит, потому что мутации, меняющие аминокислотные последовательности белков, часто снижают устойчивость белков к перегреву - это дело обычное. Но в данном случае всё оказалась интереснее. Авторы проверили термочувствительность упомянутых выше вирусов - потомков генералистов, которые в ходе дальнейшей эволюции снова стали специалистами, утратив способность прикрепляться к одному из двух рецепторов. У этих вирусов - «вторичных специалистов» в гене J еще больше мутаций по сравнению с исходным вариантом, чем у генералистов. Однако устойчивость к нагреванию у них оказалась такой же высокой, как и у «диких» вирусов. Таким образом, «генерализующие» мутации снизили термостабильность, а «специализирующие» снова ее повысили.
Самый интересный результат был получен, когда авторы проанализировали временну ю динамику разрушения вирусных частиц при оптимальной для них температуре 37°С. В опыте использовали штаммы с максимальной и минимальной термоустойчивостью, то есть вирусы «дикого типа» и генералистов с семью мутациями (этим двум генотипам соответствуют черная и зеленая сплошные линии на рис. 2). Оказалось, что генералисты со временем разрушаются быстрее, чем «дикие» вирусы. Это ожидаемый результат, потому что от менее термоустойчивых вирусов следует ожидать и меньшей устойчивости при оптимальной температуре. Интереснее другое: исследователи обнаружили, что в течение первых двух суток разрушение вирусов дикого типа идет с постоянной скоростью, тогда как генералисты намного быстрее деградируют в первые сутки, чем во вторые (рис. 3).

Но если все вирусные частицы в выборке одинаковы, то они должны разрушаться с постоянной скоростью. Полученный результат говорит о том, то вирусы-генералисты, по-видимому, представлены двумя разными фенотипами, один из которых неустойчив и разрушается быстро (в основном в течение первого дня), а другой - медленно (примерно с той же скоростью, что и «дикие» вирусы). Однако генотип у всех генералистов один и тот же. Стало быть, речь идет о негенетической изменчивости. Скорее всего, дело тут в разных вариантах сворачивания белка J.
Дальнейшие эксперименты дали ряд косвенных подтверждений этому предположению. Удалось показать, что быстро разрушающаяся фракция вирусов-генералистов преимущественно связывается с OmpF, а медленно разрушающаяся - с LamB. Это видно, например, из того, что по мере разрушения вирусных частиц среди вирусов-генералистов остается все меньше способных связываться с OmpF, в то время как доля связывающихся с LamB растет. А если отобрать те вирусы, которые связались с OmpF, то оставшиеся вирусы, во-первых, лучше связываются с LamB, чем исходная смесь, во-вторых, со временем разрушаются медленнее. Дополнительные эксперименты подтвердили, что изменчивость у вирусов-генералистов действительно негенетическая, то есть ненаследственная.
В итоге вырисовалась следующая схема появления эволюционного новшества. В ходе адаптации к жертвам с пониженной экспрессией рецептора LamB отбор стал поддерживать у вирусов такие мутации в гене J , которые позволяли белку J прочнее связываться с LamB. Это достигалось ценой дестабилизации белка J, который в результате стал иногда сворачиваться неправильно. После приобретения четырех таких мутаций (каждая из которых повышала сродство J к LamB) у белка J появился новый вариант сворачивания, который позволял связываться с другим рецептором - OmpF. Белок с новой функцией возник как один из вариантов фенотипа в рамках негенетической изменчивости. При одном и том же геноме часть вирусов теперь могла связываться с OmpF, в то время как другие обладатели того же генотипа связывались с LamB. Так появились вирусы-генералисты. При этом каждая отдельная вирусная частица намного эффективнее связывалась с одним из двух рецепторов, чем с другим. Генерализация произошла на уровне популяции, а не индивида.
В дальнейшем вирусы-генералисты могут снова специализироваться, попав в подходящие условия (то есть получив доступ к жертвам, у которых есть либо только LamB, либо только OmpF). В ходе специализации закрепляются мутации, повышающие вероятность того, что белок J свернется выгодным в данной ситуации образом. В результате белок J снова стабилизируется, то есть начинает сворачиваться только одним способом. При этом восстанавливается также и устойчивость белка (и всего вируса) к повышенной температуре.
Таким образом, найден яркий пример появления новой функции через промежуточный этап, связанный с дестабилизацией фенотипа. Остается неясным, как часто возникают таким способом эволюционные инновации у вирусов и клеточных организмов. Ответ на этот вопрос должны дать дальнейшие исследования.
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Первые слова из определения Ф.Энгельсом понятия жизни "Жизнь есть способ существования белковых тел, .... " до сих пор, по прошествии полутора веков, не потеряли своей правильности и актуальности.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген
, эластин
, кератин
, протеогликаны
.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин
(поверхностный, основной белок цитоскелета эритроцитов), гликофорин
(интегральный, фиксирует спектрин на поверхности).
К данной функции можно отнести участие в создании органелл – рибосомы
.
Ферментативная функция
Все ферменты являются белками.
В то же время есть данные о существовании рибозимов , т.е. рибонуклеиновых кислот, обладающих каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови , например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки - Na + ,К + -АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са 2+ -АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры .
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина
.
У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей
и печени
.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин , актин , миозин ).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови - например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны .
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови .
Белковая буферная система участвует в поддержании кислотно-щелочного состояния .
Существуют белки, которые являются предметом особого изучения:
Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению.
Резилин – обладает почти идеальной эластичностью, составляет „шарниры" в местах прикрепления крыльев насекомых.
Белки со свойствами антифриза обнаружены у антарктических рыб, они предохраняют кровь от замерзания
- Вперёд >
Белки, связанные с микротрубочками (MAP), регулируют их сборку, стабилизируя или дестабилизируя микротрубочки
MAP определяют степень вероятности роста или диссоциации микротрубочки
MAP могут присоединяться к различным сайтам на микротрубочках. Некоторые белки связываются с телом трубочки, некоторые только с концами. Другие связываются только с димерами тубулина, предотвращая их дальнейшую полимеризацию
Оборачиваемость микротрубочек регулируется изменением баланса между активными стабилизаторами и дестабилизаторами
Активность MAP регулируется их фосфорилированием
MAP также способны связывать мембраны или белковые комплексы с микротрубочками
Являясь компонентом цитоскелета , микротрубочки используются клеткой для выполнения разнообразных функций. В одних случаях необходимы стабильные микротрубочки, в других используются динамические. Часто в клетках, к стенкам или концам микротрубочек присоединяются органеллы или другие структуры (включая прочие компоненты цитоскелета). Для выполнения всех этих задач клетки используют ряд белков, которые называются белками, связанными с микротрубочками (англ. microtubule-associated proteins, MAP). Некоторые MAP модифицируют динамическую нестабильность, активируя или ингибируя процессы полимеризации или деполимеризации тубулина на концах микротрубочек.
Другие функционируют в качестве линкеров между концами микротрубочек и мембранными везикулами или другими микроструктурами. Некоторые МАР выполняют обе функции, регулируя сборку микротрубочек и связывание с ними различных компонентов.
Впервые МАР были идентифицированы в составе белков препаратов микротрубочек, выделенных из ткани головного мозга млекопитающих. Эта процедура схематически представлена на рисунке ниже. Два белка, названные МАР2 и tau, обнаружены только в нейронах, и обеспечивают существование долгоживущих микротрубочек, необходимых для функционирования аксонов и дендри-тов. Они присоединяются вдоль тела микротрубочек Поскольку эти белки присоединяются сразу к нескольким субъединицам тубулина, они определяют частоту наступления переходов динамической нестабильности.
Оба белка подавляют наступление катастроф и сильно увеличивают вероятность спасения микротрубочек , тем самым делая маловероятной их разборку. В результате образуются длинные микротрубочки, которые существуют гораздо дольше, чем это возможно для микротрубочек, содержащих только тубулин. Обычно эти белки связываются по длине всей микротрубочки, покрывая ее поверхность, и выглядят как скобы, укрепленные на стенке микротрубочки, сильно затрудняющие отщепление субъединиц.
Показано, как были идентифицированы первые MAP.Для этого использовали головной мозг, поскольку нейроны содержат много микротрубочек.
Ткань мозга гомогенизировали в среде, вызывающей деполимеризацию микротрубочек.
При последующем центрифугировании удалялись неразрушенные тканевые фрагменты,
и в супернатанте оставались только растворимые белки, включая тубулин, который содержится во всех микротрубочках нейронов головного мозга.
После деполимеризации тубулина микротрубочки осаждали повторным центрифугированием.
Наряду с а- и b-тубулином, обнаруживалось много других белков.
Некоторые белки связываются только с плюс-концами микротрубочек . Они обозначаются как «+TIPs». Если пометить эти белки флуоресцентной меткой, они будут выглядеть как короткие участки, расположенные на плюс-концах микротрубочек. +TIPs связываются с микротрубочкой только при наличии растущего плюс-конца и, по-видимому, способны перемещаться на растущий конец. На рисунке ниже представлена микрофотография клетки, экспрессирующей флуоресцентно меченый +TIP. Видеосъемка показывает, что белок выглядит как множество небольших комет, движущихся в цитоплазме, причем каждая комета соответствует растущему концу отдельной микротрубочки.
Предполагается, что по мере добавления новых тубулиновых субъединиц к растущему концу микротрубочки к ним присоединяются индивидуальные белки +TIP. Каждый белок остается связанным с микротрубочкой лишь в течение короткого времени и затем отщепляется. Пока белок находится в связанном состоянии, микротрубочка продолжает расти, и к ней все время добавляются новые +TIPs. Постоянное добавление белков +TIP к концу микротрубочки и их отщепление, когда они оказываются позади зоны роста, позволяет прийти к выводу, о том, что концентрация связанного +TIP белка на концах микротрубочек всегда выше.
С концами микротрубочек связываются несколько различных групп белков. Один из белков, родственный +TIP, обнаружен в различных клетках и называется CLIP-170. Этот белок служит примером MAP белка, обладающего двумя функциями, поскольку он способен стабилизировать микротрубочки, способствуя их спасению, а также связывать с ними эндосомы.
Когда в клетке возникает необходимость в очень динамичных микротрубочках , например в митозе, их обмен возрастает. При этом скорость обмена субъединиц увеличивается за счет MAP которые снижают стабильность микротрубочек. В основе дестабилизирующего действия белков лежит увеличение вероятности наступления катастроф, приводящих к укорачиванию микротрубочек. Они также снижают вероятность наступления спасений и до начала возобновления роста микротрубочки теряют много своих субъединиц. Дестабилизаторы реализуют свое действие по трем механизмам: они способны разрушать ГТФ-кэпы и стимулировать наступление катастроф; они могут разрезать микротрубочки на куски с образованием множества концов, способных к диссоциации; и наконец, они связывают свободные тубулиновые субъединицы, что снижает доступное для полимеризации количество тубулина. Эти механизмы представлены на
Разрезание микротрубочек происходит с помощью белка катанина, который получил свое название от японского слова «катана», что значит меч. Катанин действует, связываясь со стенкой микротрубочки и нарушая контакты между субъединицами тубулина. Для образования разреза необходимо присоединение к микротрубочке нескольких молекул катанина, а также гидролиз АТФ. Хотя механизм разрезания микротрубочек вполне понятен, пока не ясно, каким образом катанин реализует свою активность в клетке. Белок обнаружен во всех клетках, и исследования на мутантах и с применением ингибиторов свидетельствуют о том, что он участвует в основных клеточных процессах.
Например, в клетках некоторых организмов катанин необходим для сборки митотического веретена. Также белок требуется для организации микротрубочек в клетках растений. Однако в обоих случаях непонятно, каким конкретным образом он реализует свой эффект в клетке. Возможно, что он ускоряет деполимеризацию длинных микротрубочек, разрезая их на несколько частей. Это особенно необходимо для крупных клеток, таких как яйцеклетка. Впрочем, катанин может играть и другую роль. Он обнаружен в центросомах некоторых клеток, и предполагается, что белок принимает участие в отделении новообразованных микротрубочек от ЦОМТ.
Примером белка, дестабилизирующего микротрубочки за счет разрушения ГТФ-кэпа, служит кинезин, связанный с митотической центромерой (МСАК). Он является представителем группы молекулярных моторов - кинезинов и играет важную роль в контроле динамики микротрубочек в митозе. В отличие от большинства белковых моторов, МСАК не транспортирует различные молекулы. Он лишь связывается с концами микротрубочек и дестабилизирует их структуру, способствуя образованию протофиламентов, которые отклоняются от прямолинейной ориентации. Такие закрученные протофиламенты теряют контакт с соседними субъединицами, разрушается ГТФ-кэп, и микротрубочка начинает укорачиваться. Затем из деполимеризующихся тубулиновых субъединиц высвобождается МСАК, который снова может связаться с микротрубочками.
Насколько динамичными являются микротрубочки в определенный момент времени, зависит от состояния баланса между стабилизаторами и дестабилизаторами. Сдвиг баланса при активации или инактивации различных МАР повлечет за собой или увеличение стабильности микротрубочек, или усиление обмена субъединиц. Предположение о том, что динамика микротрубочек регулируется за счет баланса между стабилизирующими и дестабилизирующими МАР, впервые было выдвинуто при исследовании двух МАР из яйцеклеток лягушки - ХМАР215 (стабилизатор микротрубочек) и МСАК. Удаление из клеток белка ХМАР215 приводит к относительному увеличению содержания белка МСАК; в результате этого в клетке образуются очень короткие микротрубочки, и увеличивается частота наступления катастроф.
Напротив, удаление МСАК благоприятствует смещению баланса в сторону более стабильных микротрубочек, которые достигают значительной длины, поскольку катастрофы наступают редко. Необходим надлежащий баланс между ХМАР215 и МСАК; в противном случае образуется функционально неполноценное веретено деления.
Каким образом регулируется активность MAP? Вообще говоря, изменения стабильности микротрубочек наступают слишком быстро для того, чтобы они обеспечивались экспрессией генов, кодирующих MAP. Поэтому активность многих MAP регулируется степенью их фосфорилирования. Например, при фосфорилировании белка tau его сродство к микротрубочкам снижается. Это приводит к снижению стабилизирующих свойств белка. Фосфорилирование MAP не обязательно проходит во всей клетке. При локальной активации киназы в небольшой области клетки активность MAP может измениться только в этой области. Переключая функции стабилизаторов и дестабилизаторов между состояниями «включено» и «выключено», клетка может поддерживать баланс, обеспечивающий присутствие более стабильных или более динамических микротрубочек.
За счет локального изменения активности MAP , клетка может реагировать на поступление внешних сигналов, обеспечивая в определенных своих частях рост более длинных микротрубочек или их диссоциацию. Локальная регуляция активности MAP происходит при изменении клеточной подвижности и, в частности, при сборке митотического веретена.
Фосфорилирование белка tau связано с болезнью Альцгеймера , хотя и не показано, что изменение динамики микротрубочек играет роль при этом заболевании. Когда tau белок подвергается гиперфосфорилированию, он образует фибриллярные агрегаты, которые можно наблюдать в головном мозге больных. Неясно, являются ли изменения белка tau, которые развиваются при болезни Альцгеймера, причиной или следствием патологического процесса. Хотя причинная роль изменений белка tau при болезни Альцгеймера не установлена, некоторые другие нейродегенеративные заболевания вызываются мутациями по гену tau и также приводят к образованию фибриллярных агрегатов tau белка и к развитию болезни.
 Фотография участка клетки, сделанная с помощью флуоресцентного микроскопа.
Фотография участка клетки, сделанная с помощью флуоресцентного микроскопа.
Тубулин флуоресцирует красным, а белок ЕВ1, представитель семейства МАР, который связывается только с плюс-концами растущих микротрубочек, - зеленым.
Ядро обладает синей флуоресценцией. Белок ЕВ1 присутствует только в коротких элонгированных сегментах на концах .
 Одна из рамок видеосъемки эпителиальной клетки, показывающая флуоресцирующий +TIP и ЕВ1 белок, связанные с концами микротрубочек.
Одна из рамок видеосъемки эпителиальной клетки, показывающая флуоресцирующий +TIP и ЕВ1 белок, связанные с концами микротрубочек.
Поскольку белки +TIP связываются с растущими концами микротрубочек, они выглядят как флуоресцирующие кометы, «пролетающие» по цитоплазме.
Фактически это движение отражает рост микротрубочек.
 Механизм связывания и высвобождения белков +TIP,
Механизм связывания и высвобождения белков +TIP,
позволяющий им локализоваться на растущем конце микротрубочки.
 Три пути дестабилизации микротрубочек.
Три пути дестабилизации микротрубочек.
Удаление ГТФ-кэпа или разрыв трубочки приводят к обнажению концевых ГДФ-субъединиц и вызывают диссоциацию.
При разрыве также увеличивается число концов, способных к одновременной деполимеризации.
Связывание свободных тубулиновых субъединиц замедляет полимеризацию и увеличивает вероятность гидролиза ГТФ в субъединицах на конце каждого протофиламента.
 Размеры структур, состоящих из микротрубочек, определяются совместным действием MAP,
Размеры структур, состоящих из микротрубочек, определяются совместным действием MAP,
которые оказывают стабилизирующее и дестабилизирующее действие.
При инактивации дестабилизаторов наступление катастрофы становится менее вероятным,
и это приводит к образованию структур, содержащих большое количество микротрубочек.
Инактивация стабилизаторов оказывает противоположное действие.
Поддержание необходимого баланса между противоположным эффектом компонентов позволяет контролировать размер структуры,
состоящей из микротрубочек, и при необходимости быстро менять его.
 При болезни Альцгеймера, являющейся нейродегенеративным заболеванием,
При болезни Альцгеймера, являющейся нейродегенеративным заболеванием,
один из MAP белков нейронов - tau, подвергается гиперфосфорилированию и образует агрегаты, состоящие из парных спирализованных филаментов.
Представлена микрофотография выделенных агрегатов, сделанная с помощью электронного микроскопа.
Еще значения слова и перевод СПИРАЛЬ-ДЕСТАБИЛИЗИРУЮЩИЕ БЕЛКИ с английского на русский язык в англо-русских словарях.
Что такое и перевод СПИРАЛЬ-ДЕСТАБИЛИЗИРУЮЩИЕ БЕЛКИ с русского на английский язык в русско-английских словарях.
More meanings of this word and English-Russian, Russian-English translations for СПИРАЛЬ-ДЕСТАБИЛИЗИРУЮЩИЕ БЕЛКИ in dictionaries.
- СПИРАЛЬ — f. spiral, helix; спираль Архимеда, spiral of Archimedes; si-ci-спираль, si-ci spiral, Nielsen"s spiral
Russian-English Dictionary of the Mathematical Sciences - СПИРАЛЬ — Spiral
- БЕЛКИ — Protein
Русско-Американский Английский словарь - СПИРАЛЬ — spiral спиралью, по спирали — in a spiral
- СПИРАЛЬ
Русско-Английский словарь общей тематики - СПИРАЛЬ — 1) цитол. coil 2) helix 3) spiral 4) spire
Новый Русско-Английский биологический словарь - БЕЛКИ — Fibers
Russian Learner"s Dictionary - СПИРАЛЬ — spiral
Russian Learner"s Dictionary - СПИРАЛЬ
Русско-Английский словарь - СПИРАЛЬ — ж. spiral спиралью, по спирали — in a spiral
Russian-English Smirnitsky abbreviations dictionary - СПИРАЛЬ — spiral
Russian-English Edic - СПИРАЛЬ — coil, curl, helix, spiral line, snail, spiral
Русско-Английский словарь по машиностроению и автоматизации производства - СПИРАЛЬ
Русско-Английский краткий словарь по общей лексике - СПИРАЛЬ — coil, helix, scroll, winding, spiral, volute
Русско-Английский словарь по строительству и новым строительным технологиям - СПИРАЛЬ — Spiral
- БЕЛКИ — Protein
Британский Русско-Английский словарь - БЕЛКИ — (блат.) деньги
- БЕЛКИ — Деньги
Англо-Русско-Английский словарь сленга, жаргона, русских имен - СПИРАЛЬ — spiral; (пружина) spiral spring; ~ый spiral; ~ная линия spiral; ~ная пружина spiral/coil spring
Русско-Английский словарь - QD - СПИРАЛЬ — см. двигаться по спирали
Русско-Английский научно-технический словарь переводчика - БЕЛКИ — БЕЛКИ Когда белки в организме распадаются до аминокислот, эти аминокислоты могут быть снова использованы для синтеза белков. В то же …
Русский словарь Colier - БЕЛКИ — БЕЛКИ Белки в твердом состоянии белого цвета, а в растворе бесцветны, если только они не несут какой-нибудь хромофорной (окрашенной) группы, …
Русский словарь Colier - БЕЛКИ — БЕЛКИ Строение. Белки - это полимеры, т.е. молекулы, построенные, как цепи, из повторяющихся мономерных звеньев, или субъединиц, роль которых играют …
Русский словарь Colier - БЕЛКИ — БЕЛКИ Для синтеза белка живой организм должен располагать системой ферментов, способных присоединять одну аминокислоту к другой. Необходим также источник информации, …
Русский словарь Colier - БЕЛКИ — (протеины), класс сложных азотсодержащих соединений, наиболее характерных и важных (наряду с нуклеиновыми кислотами) компонентов живого вещества. Белки выполняют многочисленные и …
Русский словарь Colier - СПИРАЛЬ — ж. helix
Русско-Aнглийский автомобильный словарь - СПИРАЛЬ
Большой Русско-Английский словарь - СПИРАЛЬ — спираль spiral
Русско-Английский словарь Сократ - WHISK — 1. сущ. метел(оч)ка; сбивалка (напр., для яиц) egg whisk ≈ веничек для взбивания яиц 2. гл. 1) смахивать, сгонять (часто …
- WHIP — 1. сущ. 1) а) кнут, хлыст to crack, snap a whip ≈ щелкать кнутом/хлыстом б) обметка (петель и т. п.) …
Большой Англо-Русский словарь - VOLUTE — 1. сущ. 1) спираль 2) архит. волюта; завиток (архитектурная особенность ионического стиля) 3) зоол. спиралевидная раковина брюхоногого моллюска или сам …
Большой Англо-Русский словарь - SPONGE — 1. сущ. 1) а) губка б) мед. тампон (из марли и ваты) 2) а) предметы или явления, напоминающие губку: …
Большой Англо-Русский словарь - SPIRE — I сущ. что-л. заостренной или конусообразной формы 1) шпиль, игла, острие 2) верхушка дерева 3) язык пламени 4) остроконечная башенка …
Большой Англо-Русский словарь - SPIRAL — 1. сущ. 1) а) спираль, винтовая линия - helix spiral of Archimedes б) виток (спирали) Syn: coil I 1. …
Большой Англо-Русский словарь - SNAIL — сущ. 1) улитка - snail"s pace 2) разг. а) тихоход; медлительный человек б) лежебока, лентяй Syn: sluggard 3) тех. …
Большой Англо-Русский словарь - SCROLL — 1. сущ. 1) а) свиток (на котором что-л. написано); что-л. свернутое в цилиндр Syn: roll б) уст. письмо, послание …
Большой Англо-Русский словарь - HELIX — сущ. 1) спираль, винтовая линия Syn: spiral 1. 2) архит. волюта, завиток Syn: volute 1. 3) анат. завиток …
Большой Англо-Русский словарь - GYRE — 1. сущ. 1) поэт.; книж. круговое вращение; кружение; вихрь, вихревое движение The poet evokes an atmosphere of mystery within the …
Большой Англо-Русский словарь - DISTURBING — прил. беспокоящий, волнующий It is disturbing to find evidence of widespread corruption. ≈ Свидетельства широко распространенной коррупции очень расстраивают. Syn …
Большой Англо-Русский словарь - BUN — I сущ. 1) сдобная булочка с изюмом cinnamon, sticky bun ≈ булочка с корицей 2) пучок, узел (волос) She wore …
Большой Англо-Русский словарь - WHIP — whip.ogg 1. wıp n 1. плеть, плётка; кнут; хлыст; розга; прут, хворостина to ride whip and spur - мчаться во …
Англо-Русско-Английский словарь общей лексики - Сборник из лучших словарей - SPIRAL — spiral.ogg _I 1. ʹspaı(ə)rəl n 1. спираль low spiral - передняя горизонтальная спираль «ласточка» (фигурное катание) 2. спираль, …
Англо-Русско-Английский словарь общей лексики - Сборник из лучших словарей - DISTURBING — disturbing.ogg dısʹtɜ:bıŋ a 1. вызывающий нарушение равновесия; возмущающий disturbing factors - дестабилизирующие факторы 2. тревожный, вызывающий беспокойство disturbing news - …
Англо-Русско-Английский словарь общей лексики - Сборник из лучших словарей - COIL — 1) спираль || скручивать (свёртывать) в спираль 2) виток 3) рулон (полосового материала) 4) бухта, бунт (проволоки, …
Большой Англо-Русский политехнический словарь - WHIP — 1. n 1. плеть, плётка; кнут; хлыст; розга; прут, хворостина to ride ~ and spur - мчаться во весь …
- SPIRAL — I 1. [ʹspaı(ə)rəl] n 1. спираль low ~ - передняя горизонтальная спираль «ласточка» (фигурное катание) 2. спираль, предмет …
Новый большой Англо-Русский словарь - Апресян, Медникова - DISTURBING — a 1. вызывающий нарушение равновесия; возмущающий ~ factors - дестабилизирующие факторы 2. тревожный, вызывающий беспокойство ~ news - огорчительные новости
Новый большой Англо-Русский словарь - Апресян, Медникова - WHIP — 1. wıp n 1. плеть, плётка; кнут; хлыст; розга; прут, хворостина to ride whip and spur - мчаться во весь …
- SPIRAL — _I 1. ʹspaı(ə)rəl n 1. спираль low spiral - передняя горизонтальная спираль «ласточка» (фигурное катание) 2. спираль, предмет …
Большой новый Англо-Русский словарь - DISTURBING — a 1. вызывающий нарушение равновесия; возмущающий disturbing factors - дестабилизирующие факторы 2. тревожный, вызывающий беспокойство disturbing news - огорчительные новости
Большой новый Англо-Русский словарь - PERFORINS — каналообразующие белки, пороформирующие белки, перфорины
Новый Англо-Русский словарь по биологии
Специфичность первичной структуры белка. Особенности образования пептидной связи. Определяющая роль первичной структуры в формировании более высоких уровней организации белковой молекулы.
Первичная структура белка.
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями. Первичная структура - простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между α-аминогруппой одной аминокислоты и α-карбоксильной группой другой аминокислоты.
Если в образовании пептидной связи участвует иминогруппа пролина или гидроксипролина, то она имеет другой вид.
При образовании пептидных связей в клетках сначала активируется карбоксильная группа одной аминокислоты, а затем она соединяется с аминогруппой другой. Примерно так же проводят лабораторный синтез полипептидов.
Пептидная связь является повторяющимся фрагментом полипептидной цепи. Она имеет ряд особенностей, которые влияют не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи:
Копланарность - все атомы, входящие в пептидную группу, находятся в одной плоскости;
Способность существовать в двух резонансных формах (кето- или енольной форме);
Транс-положение заместителей по отношению к С-N-связи;
Способность к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
Исключение составляют пептидные группы с участием аминогруппы пролина или гидроксипролина. Они способны образовывать только одну водородную связь (см. выше). Это сказывается на формировании вторичной структуры белка. Полипептидная цепь на участке, где находится пролин или гидроксипролин, легко изгибается, так как не удерживается, как обычно, второй водородной связью.
4.Вторичная структура белка . Связи, стабилизирующие вторичную структуру, α-спираль. Факторы, нарушающие спирализацию. β-складчатая структура, особенности конформационного строения.
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ укладки полипептидной цепи в определенную конформацию.
Процесс этот протекает не беспорядочно, а в соответствии с первичной структурой белка.
Вторичная структура поддерживается в основном водородными связями, хотя для некоторых белков определенный вклад вносят пептидные и дисульфидные ковалентные связи.
Наиболее вероятным типом вторичной структуры глобулярных белков является -спираль. Закручивание полипептидной цепи в спираль происходит по часовой стрелке. Для каждого белка характерна определенная степень спирализации. Так, полипептидные цепи гемоглобина спирализованы на 75%, а молекула пепсина - на 30%.
Тип конфигурации полипептидных цепей, когда сегменты пептидной цепи располагаются в один слой, образуя структуру, подобную листу, сложенному в гармошку, называется -структурой. Такой тип вторичной структуры обнаружен в белках мышц, волос, шелка. -Слой может быть внутримолекулярным, а также образованным двумя или более полипептидными цепями.
Способность к образованию водородных связей, являющихся движущей силой при возникновении α- и β-структур в белковой молекуле, выражена у разных аминокислот в неодинаковой степени. Выделяют группу спиралеобразующих аминокислот: ала, глн, глу, лей, мет, лиз, гис. Вал, иле, тир, тре, фен способствуют образованию -структур полипептидной цепи. Наличие сер, гли, про, асн, асп приводит к преимущественному образованию неупорядоченных фрагментов в белковой молекуле.
В природе существуют белки, строение которых не соответствует ни
β-, ни -структуре (коллаген).
5.Третичная структура белка. Связи, стабилизирующие третичную структуру (ковалентные, ионные, гидрофобные, водородные, Ван-дер-Ваальса).
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, Третичная структура белка (миоглобин кашалота) впервые была установлена методом рентгеноструктурного анализа (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основная роль принадлежит нековалентным связям (межмолекулярные ван-дер-ваальсовы силы, водородные связи, электростатические взаимодействия ионизированных групп, гидрофобные взаимодействия и т.д.).
Методом рентгеноструктурного анализа установлено существование специфических уровней структурной организации белковой молекулы, промежуточных между вторичной и третичной структурами. Домен - это компактная глобулярная структурная единица внутри полипептидной цепи (рис. 3). Открыты белки (в частности, иммуноглобулины), в которых существуют различные по структуре и функциям домены.
Согласно современным представлениям, белка после окончания синтеза белка его третичная структура формируется самопроизвольно. Процесс формирования нативной пространственной структуры полипептидной цепи - фолдинг. Основной движущей силой фолдинга является взаимодействие радикалов аминокислот с молекулами воды. При этом гидрофобные радикалы аминокислот ориентируются внутрь белковой молекулы, а гидрофильные радикалы повернуты в сторону воды.
В клетках существуют белки, названные шаперонами. Их основная функция - участие в фолдинге (рис. 4). Описан ряд заболеваний человека, имеющих наследственную природу, возникновение которых связывают с нарушением процесса фолдинга вследствие мутаций (пигментозы, фиброзы и др.).
Все биологические свойства белков связаны с образованием и сохранностью третичной структуры, называемой нативной. Белковая глобула не является абсолютно жесткой структурой: возможны обратимые перемещения фрагментов полипептидной цепи. Эти изменения не приводят к нарушению общей конформации молекулы. Факторы, влияющие на конформацию белковой молекулы - ионная сила раствора, рН среды, взаимодействие с компонентами раствора. Любые воздействия, приводящие к нарушению нативной структуры молекулы, приводят к частичной или полной утрате белком его биологических свойств.
6.Четвертичная структура белка. Понятие о мономерах и олигомерах. Зависимость свойств белка от его конформации. Взаимосвязь структуры и функции.
Четвертичная структура белка - укладка отдельных полипептидных цепей, обладающих специфической первичной, вторичной или третичной структурой, в пространстве, и формирование единого макромолекулярного образования.
Белок, состоящий из нескольких полипептидных цепей, называют олигомером, а каждую входящую в него полипептидную цепь - протомером. Олигомерные белки, как правило, состоят из четного числа псубъединиц, например, молекула гемоглобина построена из двух - и двух -полипептидных цепей (рис. 5).
Четвертичную структуру имеют около 5% белков, такие как ферритин, иммуноглобулины. Субъединичное строение свойственно многим ферментам, в первую очередь тем, которые выполняют сложные функции. Почти все ДНК- и РНК-полимеразы имеют четвертичную структуру. Полипептидные цепи, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности. Только после завершения синтеза происходит их объединение в надмолекулярную структуру. Биологическую активность белок приобретает на уровне четвертичной структуры. Стабилизация четвертичной структуры происходит при участии тех же связей, что и при формировании третичной структуры, за исключением ковалентных связей.
Ряд исследователей признают наличие пятого уровня структурной организации белков. Полифункциональные макромолекулярные комплексы разных ферментов, катализирующие весь путь превращений субстрата, получили назвение метаболонов (пируватдегидрогеназный комплекс, синтетазы ВЖК, дыхательная цепь).
Белок, выполняющий специфическую функцию в метаболизме клетки, может быть представлен несколькими формами - изофункциональными белками, или изобелками. В эритроцитах крови человека обнаружено несколько форм гемоглобина: У взрослого человека преобладающей формой является НbА. Ч Для эмбриональной стадии развития человека характерен фетальный гемоглобин HbF. Все формы гемоглобинов выполняют функцию переноса кислорода из легких в ткани, однако свойства разных гемоглобинов отличаются.
Понятие нативный белок. Понятие об аллостерических белках.
Нативный белок - белок, обладающий определенной биологической активностью.
8.Основные функции простых и сложных белков в организме: структурная, каталитическая, рецепторная, регуляторная, транспортная, защитная, сократительная и другие.
Структурная функция. В комплексе с липидами белки участвуют в образовании биомембран клеток. Структурные белки цитоскелета придают форму клеткам и многим органоидам. Примерами структурных белков являются коллаген в соединительной ткани, кератин в волосах, коже, ногтях.
Сократительная (двигательная) функция. Сократительную функцию выполняют мышечные белки (актин и миозин). Белки цитоскелета необходимы для расхождения хромосом в процессе митоза.
Питательная (резервная) функция. Овальбумины(белки яйца) - источники питания для плода. Казеин - белок молока - также выполняет питательную функцию.
Каталитическая функция. Большинство известных в настоящее время ферментов (биологических катализаторов) является белками.
Транспортная функция. Белок эритроцитов гемоглобин участвует в переносе кислорода и углекислого газа, выполняя дыхательную функцию. Альбумины сыворотки крови участвуют в транспорте липидов.
Защитная функция. В ответ на поступление в организм вирусов, бактерий, чужеродных белков, токсинов образуются защитные белки - антитела (иммунная защита). Специфические белки плазмы крови способны к свертыванию, что предохраняет от кровопотери при кровотечениях (физическая защита).
Рецепторная функция. Клеточные белки образуют специфические рецепторы и участвуют в передаче гормонального сигнала.
Гормональная функция. Группа гормонов являются белками или полипептидами, например, гормон гипофиза вазопрессин.
Другие важные функции белков - буферные свойства (обеспечение физиологического значенияе рН внутренней среды), поддержаниеь онкотического давлениея в клетках и крови, и др.
В организме людей и животных содержание белка значительно выше, чем у растений. В мышцах, легких, селезенке, почках белками приходится более 70-80% сухой массы в печени - 57%, в мозге - 45%. Низкое содержание белка в кости и в зубах - 20 и 18%. Неодинаковое содержание белка и в разных субклеточных органеллах. Больше белка в гиалоплазме (внутриклеточный сок). Если принять общий белок клетки за 100%, то на гиалоплазму приходится 40%. Митохондрии и микросомы содержат по 20%, ядро - 12%, лизосомы - 2%, пероксисомы - 2,5%, плазматическая мембрана - 1,5% белка.
В состав некоторых белков входят фосфор (0,2-2%), железо и другие элементы. Наиболее постоянным для белков животного, растительного и микробного происхождения содержание азота - в среднем 16%, на этой основе по содержанию азота рассчитывают количество белка: массу азота, установленную анализом, умножают на коэффициент 6,25 (100:16 = 6,25) .
Размер белковых молекул лежит в пределах 1 мкм до 1 нм
Гель-фильтрация, или метод молекулярных сит
Для разделения белков часто используют хроматографические методы, основанные на распределении веществ между двумя фазами, одна из которых подвижная, а другая неподвижная. В основу хроматографических методов положены разные принципы: гель-фильтрации, ионного обмена, адсорбции, биологического сродства.
Метод разделения белков с помощью гель-фильтрационной хроматографии основан на том, что вещества, отличающиеся молекулярной массой, по-разному распределяются между неподвижной и подвижной фазами. Хроматографическая колонка заполняется гранулами пористого вещества (сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор".
Неподвижная фаза - жидкость внутри гранул, в которую способны проникать низкомолекулярные вещества и белки с небольшой молекулярной массой. Смесь белков, нанесённую на хроматографическую колонку, вымывают (элюируют), пропуская через колонку растворитель. Вместе с фронтом растворителя движутся и самые крупные молекулы.
Более мелкие молекулы диффундируют внутрь гранул сефадекса и на некоторое время попадают в неподвижную фазу, в результате чего их движение задерживается. Величина пор определяет размер молекул, способных проникать внутрь гранул (рис. 1-55).
Так как гелевая структура сефадекса легко деформируется под давлением, гели стали заменять более жёсткими матрицами (сефактил, той-оперл), представляющими сферические гранулы с разными размерами пор. Выбор размеров пор в гранулах зависит от целей хроматографии (о других хроматографических методах будет сказано ниже).